MOL-berekeningen
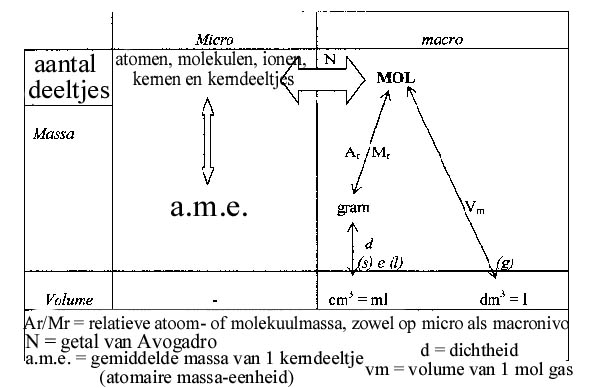
Onderstaand diagram toont de relatie tussen de eenheden op micro-nivo (atomen e.d.) en op macro-nivo (grammen e.d.) met de eenheid MOL in het centrum:
Voorbeeld 1:
Van de stof CuSO4.5H2O wordt 4 gram afgewogen.
Hoeveel MOL gehydrateerd kopersulfaat (lichtblauwe kristallen) is dat? Gebruik tabel V.
Antwoord:
Van gram naar MOL moet je de molecuulmassa gebruiken. Hier: Cu + S + 9O + 10H = 63,5 + 32,1 + 144 + 10 = 249,6
249,6 gram van de stof (gehydrateerd kopersulfaat)= 1 MOL. 1 gram = 1/249,6 MOL
1 gram = 1/249,6 MOL
 4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram CuSO4.5H2O is dus gelijk aan 0,016 MOL CuSO4.5H2O
ofwel: 0,016 MOL CuSO4.5H2O weegt vier gram.
Voorbeeld 2:
Stel dat een glas bier (100 ml=een pijpje) 5 ml alcohol bevat (C2H5OH, dichtheid van alcohol= 0,8g/ml)
hoeveel gram alcohol zit er in een liter bier?
Antwoord:
We kennen het aantal ml, maar gevraagd wordt naar grammen van een vloeistof (alcohol)
dus je begrijpt, we zullen de dichtheid nodig hebben. d = 0,8 d.w.z.: 1 ml alcohol heeft een massa van 0,8 gram. 5 ml weegt 5 x 0,8 gram (= 4 gram).
5 ml weegt 5 x 0,8 gram (= 4 gram).
Eén glas (=100 ml bier) bevat 5 ml = 4 gr alcohol 1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
Onderstaand diagram toont de relatie tussen de eenheden op micro-nivo (atomen e.d.) en op macro-nivo (grammen e.d.) met de eenheid MOL in het centrum:

Voorbeeld 1:
Van de stof CuSO4.5H2O wordt 4 gram afgewogen.
Hoeveel MOL gehydrateerd kopersulfaat (lichtblauwe kristallen) is dat? Gebruik tabel V.
Antwoord:
Van gram naar MOL moet je de molecuulmassa gebruiken. Hier: Cu + S + 9O + 10H = 63,5 + 32,1 + 144 + 10 = 249,6
249,6 gram van de stof (gehydrateerd kopersulfaat)= 1 MOL.
 1 gram = 1/249,6 MOL
1 gram = 1/249,6 MOL
 4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram = 4 x 1/249,6 MOL = 0,016 MOL
4 gram CuSO4.5H2O is dus gelijk aan 0,016 MOL CuSO4.5H2O
ofwel: 0,016 MOL CuSO4.5H2O weegt vier gram.
Voorbeeld 2:
Stel dat een glas bier (100 ml=een pijpje) 5 ml alcohol bevat (C2H5OH, dichtheid van alcohol= 0,8g/ml)
hoeveel gram alcohol zit er in een liter bier?
Antwoord:
We kennen het aantal ml, maar gevraagd wordt naar grammen van een vloeistof (alcohol)
dus je begrijpt, we zullen de dichtheid nodig hebben. d = 0,8 d.w.z.: 1 ml alcohol heeft een massa van 0,8 gram.
 5 ml weegt 5 x 0,8 gram (= 4 gram).
5 ml weegt 5 x 0,8 gram (= 4 gram).
Eén glas (=100 ml bier) bevat 5 ml = 4 gr alcohol
 1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]
1 liter (=1000 ml) moet dan dus 10 x zoveel bevatten = 40 gram alcohol [dat is al genoeg om heel wat hersencellen in hun groei te remmen!!]