Koolstofatoom
Om meerdere redenen is het Koolstofatoom heel speciaal:
Om dat allemaal te begrijpen is het nodig je te verdiepen in de "orbitalen" van het koolstofatoom. Daarvan zijn er twee van belang voor het aangaan van bindingen: de onderschillen 2s en 2p.
Deze orbitalen kunnen op meerdere manieren samenwerken (bij het vormen van bindingen), o.a. kunnen ze zich met elkaar mengen en "hibriden" vormen:sp3, sp2, sp.
Hieronder een poging om dit duidelijker te maken:
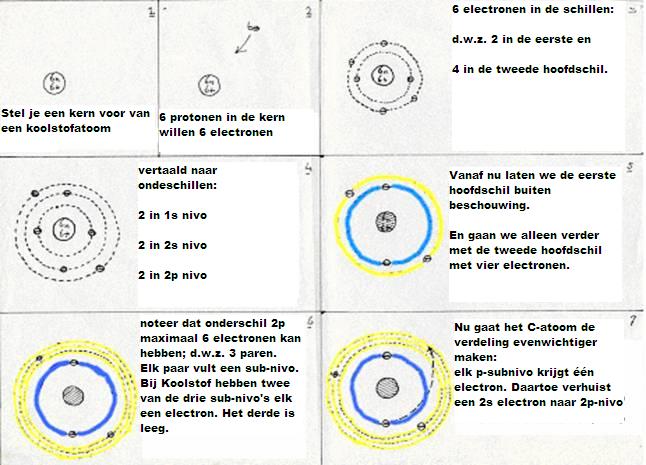
De subniveau's van koolstof zijn: 1s2 2s2 2p2
De eerste hoofdschil 1s2 ondergaat geen enkele verandering, wat het koolstofatoom ook doet, maar in de tweede hoofdschil vindt een soort reorganisatie plaats:
De vier valentie-elektronen (twee s en twee p) hebben een manier gevonden om tot een stabielere situatie te geraken:
Naast deze sp3-hybridisatie bestaan er nog twee andere mogelijkheden:
In benzeen en vergelijkbare stoffen heeft elk C-atoom drie orbitalen van het type sp2, die dus per C-atoom drie σ-bindingen vormt. Dan zijn er per C-atoom (dus in een benzeenring 6 in totaal) 2p-orbitalen, die elkaar zodanig overlappen dat ze het molecuul stabiliseren met deze zeer speciale 'vierde' binding van het type π (aromatisch).
- Elk koolstofatoom kan vier bindingen aangaan, wat veel is in vergelijking met andere atomen.
- Het koolstofatoom verbindt zich gemakkelijk met andere koolstofatomen. Silicium doet dat ook min of meer, maar verder 'houden atomen daar niet van'. Meestal koppelen atomen liever aan atomen van een ander type. Er is een voorkeur voor het koppelen van verschillende elementen. Behalve bij Koolstof dus.
Om dat allemaal te begrijpen is het nodig je te verdiepen in de "orbitalen" van het koolstofatoom. Daarvan zijn er twee van belang voor het aangaan van bindingen: de onderschillen 2s en 2p.
Deze orbitalen kunnen op meerdere manieren samenwerken (bij het vormen van bindingen), o.a. kunnen ze zich met elkaar mengen en "hibriden" vormen:sp3, sp2, sp.
Hieronder een poging om dit duidelijker te maken:
De subniveau's van koolstof zijn: 1s2 2s2 2p2
De eerste hoofdschil 1s2 ondergaat geen enkele verandering, wat het koolstofatoom ook doet, maar in de tweede hoofdschil vindt een soort reorganisatie plaats:
De vier valentie-elektronen (twee s en twee p) hebben een manier gevonden om tot een stabielere situatie te geraken:
- eerst: een elektron 2s wordt een elektron 2p (gaat dus wat verder van de kern af, en dat kost energie).
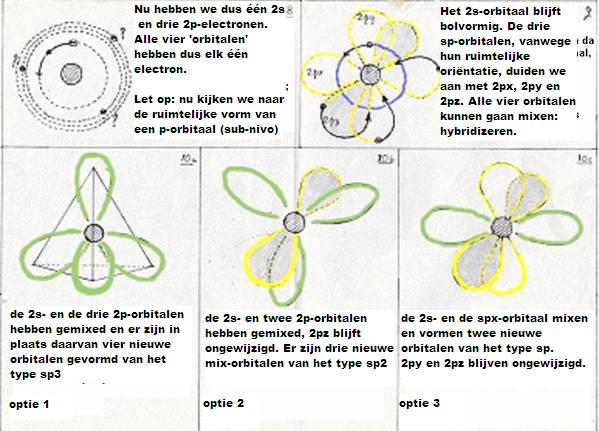
De nieuwe configuratie is dus: 1s2 2s1 2p3 - daarna: de vier niveau's in hoofdschil 2 gaan nu mixen en hybrides vormen.
Ofwel: Eén 2s-orbitaal en drie 2p-orbitalen doen mee aan die hybridizatie.
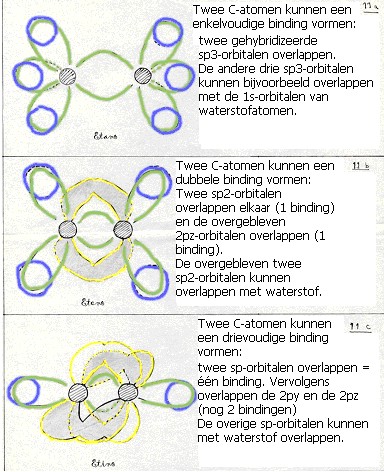
Ze vormen vier nieuwe orbitalen van het type sp3 (hierbij komt energie vrij = exotherm heet dat).
Deze vier nieuwe en aan elkaar gelijke orbitalen zijn verantwoordelijk voor de vier (gelijkwaardige en enkelvoudige) bindingen van een koolstofatoom.
Naast deze sp3-hybridisatie bestaan er nog twee andere mogelijkheden:
- De eerste (even herhalen van hierboven) is dus het hybridiseren van een 2s-orbitaal met drie 2p-orobitalen tot vier nieuwe orbitalen van het type sp3
- De tweede mogelijkheid is dat één 2s- en niet drie, maar twee 2p-obitalen meedoen aan de hybridisatie.
Dan vormen zich drie nieuwe orbitalen van het type sp2
en er blijft één oude 2p-orbitaal over; die kan zorgen voor een extra binding.
(dubbele binding: 1 binding is dan van het type σ en één binding is dan π). - De derde mogelijkheid is dat één 2s-orbitaal en slechts één 2p-orbitaal meedoen aan de hybridisatie.
Dan vormen zich twee nieuwe orbitalen van het type sp en blijven er twee oude 2p-orbitalen over;
zo kan een drievoudige binding ontstaan tussen twee C-atomen (één binding σ en twee bindingen π).
In benzeen en vergelijkbare stoffen heeft elk C-atoom drie orbitalen van het type sp2, die dus per C-atoom drie σ-bindingen vormt. Dan zijn er per C-atoom (dus in een benzeenring 6 in totaal) 2p-orbitalen, die elkaar zodanig overlappen dat ze het molecuul stabiliseren met deze zeer speciale 'vierde' binding van het type π (aromatisch).


