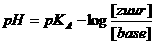Opgave 09-38
- Je hebt 500 ml oplossing van 25 graden Celcius van 0,1M NaAc (natriumacetaat). Toevoeging van 2 ml 2M HCl verlaagt meteen de pH van 8,87 naar 3,68
- Diezelfde toevoeging aan 500 ml buffermengsel van 0,1M HAc en 0,1M NaAc verlaagt de pH slechts van 4,74 naar 4,68
- Voeg je aan datzelfde buffermengsel niet zuur, maar 2 ml 2M NaOH toe, dan stijgt de pH slechts een heel klein beetje.
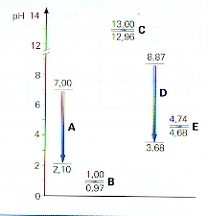
In de figuur zie je net zulke veranderingen: vijf keer wordt er 2 ml 2M HCl toegevoegd aan 500 ml
- zuiver water
- een oplossing van 0,1M sterk zuur
- een oplossing van 0,1M sterke base
- een oplossing van 0,1M zwakke base
- een buffermengsel
- controleer de beweringen van I en II hierboven door berekeningen met de bufferformule.
- bereken de verandering van pH van bovenstaande toevoeging (III) van 2 ml 2M NaOH aan 500 ml buffer 0,1M NaAc/HAc
- Controleer en verklaar de gegevens in het diagram.
Antwoord:
a.
Je hebt 500 ml oplossing van 25 graden Celcius van 0,1M NaAc (natriumacetaat).
Toevoeging van 2 ml 2M HCl verlaagt meteen de pH van 8,87 naar 3,68
Je hebt 2 ml 2M HCl. Dat wil zeggen: HCl heeft een concentratie van 2 mol/l = 2·10-3mol HCl/ml en dus 4·10-3mol HCl/2 ml
Kortom: je voegt 4·10-3mol HCl toe aan 500 ml 0,1M HaAc
0,1M HAc betekent: 10-1mol HAc/l = 0,5·10-1mol HAc/500 ml
Je voegt dus 4·10-3mol HCl samen met 0,5·10-1mol HAc
HCl is sterk en is volledig gesplitst in ionen dus er zijn 4·10-3mol H+ in 502 ml
HAc is zwak en het evenwicht HAc  H+ + Ac- zal door de aanwezigheid van flink wat H+ (afkomstig van het HCl) ver naar links worden gestuurd.
H+ + Ac- zal door de aanwezigheid van flink wat H+ (afkomstig van het HCl) ver naar links worden gestuurd.
Dit evenwicht draagt daarom vrijwel niets bij aan de hoeveelheid H+.
De concentratie [H+] (of ook [H3O+] is dus 4·10-3mol H+ / 502 ml = 1000/502 · 4·10-3mol H+ / l = 0,002008 mol/l → pH = 3-log2,008 = 3-0,303 = 2,67
b.
Diezelfde toevoeging aan 500 ml buffermengsel van 0,1M HAc en 0,1M NaAc verlaagt de pH slechts van 4,74 naar 4,68, dus een verlaging met slechts 0,06
Je voegt dus 2·10-3mol HCl toe, maar nu aan een buffermengsel.
Het buffermengsel vòòr de toevoeging heeft een pH die je volgens de bufferformule kan berekenen:
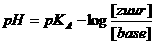
De waarde van pKA van de buffer azijnzuur-acetaat vind je in tabel I {=±4.
In andere tabellen zul je preciesere waarden aantreffen. Laten we hier maar gewoon met 4 rekenen, dat is minder exact dan waar bovenstaande opgave mee gewerkt heeft, maar dat geeft even niks}
We vullen de waarde 4 in in de bufferformule.
De concentraties van het zuur HAc en van de base Ac- zijn beide: 0,1.
Die waarden vullen we in in de bufferformule. Antwoord: pH = 4
In de bewering moet het zijn 4,74, dus zij passen veel exactere waarden toe van de zuurkonstante. Vandaar.
Voegen we 2·10-3mol H+ toe, dan reageert dat meteen met evenzoveel zwakke base Ac- en wordt er evenzoveel zwak zuur HAc bijgevormd.
De concentraties worden:
[HAc] = 0,05 + 0,002 mol/502 ml = ±0,104 mol/l
[Ac-] = 0,05 - 0,002 mol/502 ml = ±0,096 mol/l
Volgens de bufferformule wordt het nu: pH = pKA - log[zuur]/[base] = 4 - log [0,104 / 0,096] = 4 - log 1,083 = 4 - 0,035 = 3,965
de pH zakt dus met 0,035
De gegeven daling van 4,74 naar 4,68, is een verlaging van 0,06; ook heel weinig, maar onze berekening is gebaseerd op een grove pH schatting van 4. Maar je ziet dat de invloed op de pH door deze toevoeging zeer gering is.
c.
Voeg je aan datzelfde buffermengsel niet zuur, maar 2 ml 2M NaOH toe, dan stijgt de pH slechts een heel klein beetje.
Voegen we 2·10-3mol OH- toe, dan reageert dat meteen met evenzoveel zwak zuur HAc en wordt er evenzoveel zwakke base Ac- bijgevormd.
De concentraties worden:
[HAc] = 0,05 - 0,002 mol/502 ml = ±0,096 mol/l
[Ac-] = 0,05 + 0,002 mol/502 ml = ±0,104 mol/l
Volgens de bufferformule wordt het nu: pH = pKA - log[zuur]/[base] = 4 - log [0,096 / 0,104] = 4 - log 0,92 = 4 - -0,035 = 4,035
de pH stijgt dus met 0,035